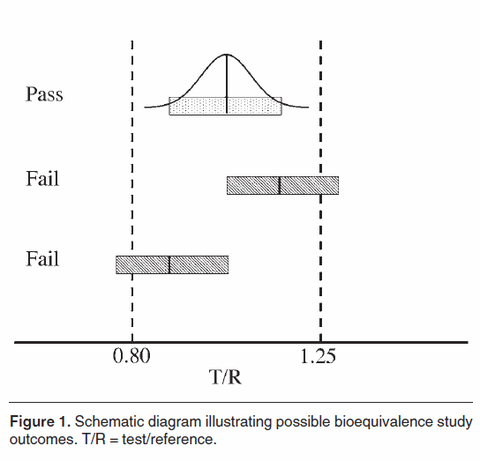
Un des principaux reproches fait par les adversaires des génériques est l’apparemment très large fourchette de tolérance (entre 80 et 125%) acceptée par les autorités sanitaires françaises lors de la détermination de la bioéquivalence d’un générique et d’un princeps.
Je n’ai jamais trouvé d’explications bien satisfaisantes sur ces limites. Pourquoi elles et pas d’autres ?
La plupart des documents sont soit non explicatifs, soit tellement techniques que je n’y comprends strictement rien.
Mais on va quand même essayer d’éclaircir un peu les choses.
Premièrement, ce n’est pas l‘action qui varie entre 80 et 125%, mais la biodisponibilité.
 Byers JP, Sarver JG. Pharmacokinetic Modeling. In Hacker M, Bachmann K, Messer W. Pharmacology Principles and Practice. London: Academic Press; 2009. p. 202.
Byers JP, Sarver JG. Pharmacokinetic Modeling. In Hacker M, Bachmann K, Messer W. Pharmacology Principles and Practice. London: Academic Press; 2009. p. 202.
Par exemple, pour le clopidogrel, si tant est que l’on puisse mesurer son action autrement que par des critères cliniques ce serait par un test d’agrégabilité plaquettaire. Sa biodisponibilité est mesurée notamment par l’aire sous la courbe (ASC en français, AUC en anglais) des concentrations plasmatiques de clopidogrel en fonction du temps (AUC 0-t).
La biodisponibilité est censée être un reflet de l’efficacité. Tout le système de la bioéquivalence repose sur cette approximation. Après, on peut s’écharper sans fin pour savoir quelle est l’exactitude de cette approximation. Je ne vais pas rentrer dans ce débat.
Deuxièmement, et cela me semble bien plus important, ces bornes sont des bornes maximales d’acceptabilité.
C’est à dire qu’elles ne reflètent pas du tout la différence de biodisponibilité effectivement constatée entre un générique et un princeps.
Je vais prendre un exemple « chaud », un essai de bioéquivalence entre le Plavix® et le clopidogrel Mylan® qui a permis à ce dernier d’obtenir une AMM européenne.
Ce princeps et ce générique contiennent des sels différents: chlorydrate pour le générique et hydrogène sulfate pour le princeps. Mais dans les deux cas, c’est bien la biodisponibilité du clopidogrel que l’on mesure (petit rappel sur le métabolisme du clopidogrel ici).
Cet essai est disponible ici, à partir de la page 10.
Je ne vais pas décrire le protocole qui est le même pour la plupart des essais de bioéquivalence. Ici, on a étudié 96 sujets sains.
Les résultats sont les suivants (page 12) et représentent la disponibilité du clopidogrel dans le plasma:
Comme ça, ça fait peur, mais en fait, ce n’est pas si compliqué que cela.
On va se contenter de regarder la première colonne, c’est à dire l’aire sous la courbe entre t0 et un instant t: AUC 0-t.
Test, c’est le générique, Reference le princeps.
Ratio, c’est le rapport entre l’aire sur la courbe du test sur celle de la référence. C’est ce ratio dont l’intervalle de confiance doit se situer entre 80% et 125%. Ici, ce ratio est de 100% avec un intervalle de confiance de 90-110% On est donc parfaitement au sein des bornes.
BM Davit et al. Ann. Pharmacother., Oct 2009; 43: 1583 – 1597.
On va regarder très rapidement les autres colonnes: les Cmax (la concentration maximale de clopidogrel), Tmax (le temps mis pour arriver à la Cmax), et la demi-vie sont sensiblement les mêmes pour le générique et le princeps.
Voici deux autres exemples de ratios observés pour AUC 0-t:
- clopidogrel Sandoz®: 90.43%
- clopidogrel Qualimed®: 100%
Maintenant, vous allez me dire que ce ne sont que 3 exemples.
J’en conviens parfaitement.
Mais il y a des gens qui ont regardé de près cette fameuse différence effective. Ils ont étudié 2070 essais de bioéquivalence déposés depuis 12 ans devant la FDA.
La différence moyenne observée entre les aires sous la courbe du princeps et du générique est de…3.56%.
Dans 98% des cas, cette différence était inférieure à 10%. Le résumé de cette étude publiée dans Annals of Pharmacotherapy est ici.
Un argument des adversaires des génériques souligne que l’aspect du générique peut troubler les patients. Mais je pense qu’un peu de pédagogie peut le plus souvent améliorer les choses.
Enfin, ils accusent parfois les autorités sanitaires de ne pas analyser les génériques avec la même rigueur que les princeps.
Le problème est que de nombreuses autorités sanitaires, et non des moindres (EMA, FDA, autorités sanitaires japonaises, australiennes, sud-africaines, canadiennes) utilisent grosso modo les mêmes limites 80-125 et les mêmes protocoles d’études de pharmacovigilance.
Admettons que l’Afssaps (qui suit les protocoles de l’EMA, mais admettons quand même) soit aux ordres de Roselyne qui veut faire des économies à tout prix sur le dos des patients, j’arrive plus difficilement à comprendre que notre brillante Ministre ait une telle influence au niveau mondial. Dans le même ordre d’idées, j’ai du mal à imaginer une telle unanimité autour de protocoles qui seraient si peu rigoureux.
Peut-être un complot mondial concocté par un groupe de génériqueurs qui tire les ficelles du fond de leur base secrète édifiée sous le volcan Eyjafjöll ?
(c’est en réalisant un essai clinique de bioéquivalence de l’ExforgeHCT® qu’ils auraient accidentellement provoqué la fameuse éruption)
Je n’y crois pas trop.
°0°0°0°0°0°0°0°0°0°0°0°0°0°
EPARs for authorised medicinal products for human use (lettre C, pour Clopidogrel)
CPMP. Note for Guidance on the Investigation of Bioavailability and Bioequivalence.
CHMP. Guideline on the Investigation of Bioequivalence.
History of Bioequivalence for Critical Dose Drugs. Gary Buehler, R. Ph. Acting Deputy Director Office of Pharmaceutical Science FDA. April 13, 2010 (présentation PPT).
Barbara M Davit, Patrick E Nwakama, Gary J Buehler, Dale P Conner, Sam H Haidar, Devvrat T Patel, Yongsheng Yang, Lawrence X Yu, and Janet Woodcock. Comparing Generic and Innovator Drugs: A Review of 12 Years of Bioequivalence Data from the United States Food and Drug Administration. Ann. Pharmacother., Oct 2009; 43: 1583 – 1597.
Rapport du CNOM sur le médicament générique, 4 février 2010.
Bioavailability and Bioequivalence. Jake J. Thiessen. Site de l’IUPHAR.
°0°0°0°0°0°0°0°0°0°0°0°0°
16/06/10, 17/06/10 et 20/06/10: pas mal de petites modifications, c’est confirmé, j’ai besoin de vacances!
26/07/10: ré-actualisation en fonction du nouveau site de l’EMA
09/12/10: modification de la note


BRAVO ! Il fallait oser se lancer dans l’explication bien nécessai de cette notion de 80-125. J’avoue ne jamais en avoir eu le courage. C’est super et, surtout, cela montre à quoi certains sont prêts pour ne pas laisser leurs sponsors affronter seuls les vilains génériques ! Si on pouvait coller des stickers sur les blouses blanches de certains universitaires, on aurait plus l’impression de voir des combianisons de pilotes de F1 que de brillants esprits censés dispenser librement leur savoir.
Encore une fois BRAVO !
Je penche pour le deuxième « soit ».
l’idée d’offrir une blouse avec broderie du nom des marques déclarées en conflit d’intéret par les cumulards est vraiment excellente! d’autres auraient droit plus simplement à la combinaison S. avec boules quiès intégrées ,des cravates aux couleurs bien criardes des pubs…
la pharmaco c’est passionnant ! le vrai problème est que la bioèquivalence cinètique définie ici présuppose la bioéfficacité secondaire analogue ce qui est en général vrai mais pas toujours dans les percentiles plus ou moins extrèmes pour des mèdocs à effet seuil surtout type anti-épileptique l’embrouille devient extrème si le critère d’évaluation est erratique je n’ose imaginer un avk générique, beaucoup de crispations actuellement par chez moi sur la substitution thyroidienne :les tsh montent sous générique§§§
Uhmm, pareil que toi, je pense que tout n’est pas généricable. Le cas de la lévothyroxine me laisse très songeur…
Audacieux!
AAaaah ben ça c’est un article pour ingénieur, je peux comprendre ;o)
Au rayon rien à voir… ya quelqu’un qui sait ce qui est arrivé au blog du « toubib est généraliste » ? son sous verre me manque 😉
Bonjour Jean-Marie,
Certes, les adversaires des génériques sont parfois « suspects ». Néanmoins, il y a vraiment un problème comme l’atteste la réponse très politique de Lechat à ma lettre à l’AFSSAPS http://www.atoute.org/n/article85.html
Il ne répond pas à ta question, surtout!
Les études de bioéquivalence sont décrites dans les EPARs de chaque molécule génériquée ici: http://www.ema.europa.eu/htms/human/epar/a.htm
Tu choisis la molécule et tu cliques sur le losange « Public assessment report » dans le tableau.
C’est comme cela que j’ai trouvé le protocole et les résultats pour le clopidogrel que j’ai pris en exemple.
Sinon, ces protocoles sont très stéréotypés, et tu trouveras leurs trames dans la deuxième et la troisième référence.
Merci. J’ai cherché en vain par exemple les génériques du propranolol.
Je pense que c’est parce que les AMM sont trop anciennes pour apparaître sur le site de l’EMA.
A l’époque, tout n’était pas autant « centralisé ».
Les études doivent donc être enfermées dans les coffres de l’Afssaps ou de la HAS!
J’ai trouvé ça: https://tspace.library.utoronto.ca/bitstream/1807/5852/1/gm04043.pdf
Mais il n’est pas commercialisé en France 😉
le pb de la levothyroxine m’intéresse pour un membre de ma famille , pouvez vous me donner qq liens là dessus ?
qq questions naïves :qui fabrique les génériques ? en france ou ailleurs ? si la fabrication de ces médicaments moins chers se fait au prix de délocalisations, je ne suis pas sûr que ce soit bien rentable pour la sécu
Je n’ai pas d’infos précises sur la levothyroxine, seulement le communiqué de l’Afssaps (http://www.afssaps.fr/content/download/26054/344426/version/1/file/lp-100524-Levothyroxine.pdf)
Où les génériques sont fabriqués, bonne question.
En général, personne ne se bouscule au portillon pour le clamer!
Parfait, comme d’habitude !
ALORS? DOIS-je prendre un anti histaminique génériqué ou pas quand je vois un(e) visiteur ( teuse ) médical(e)
Tres belle note:)
Il faut surtout regarder les règles de fabrication des médicaments princeps car l’histoire de l’intervalle de confiance dans la mesure des poudres et donc des quantités principe actif et d’excipient permet une variation de dose entre les différents cachets;) comprimés gelules suppos gouttes collyres ect…) d’un même lot, voir même d’une même boite, pire encore deux comprimés de places voisines dans un blister ne contiennent pas exactement la même dose.
Donc si on ajoute à cela le fait que la machine qui fabrique les comprimés n’a pas pressé exactement avec la même force les comprimés,
que la pression atmospherique à chutée malgrès les previsions d’Evelyne Dheliat entrainant une augmentation de l’humidité de certain comprimés entrainant un délitement du comprimé plus rapide et une dégradation du principe actif « hydrolabile » plus rapide alors on se doute que l’intervalle de confiance de l’AUC du princeps varie aussi: reste à savoir les bornes d’acceptabilités qui ne doivent pas etre difficile à trouver dans le dossier d’amm de chaque spécialité.
Une autre question viens d’être posée et la reponse apportée par l’afssaps ma fait beaucoup rire!!! à l’invective : « les génériques sont fabriquée en PVD pour limiter les frais! »
la réponse à été : « Oui ! et à votre avis ou sont fabriqué leur princeps? »
pour information 100% du paracetamol mondial provient d’inde!
les seuls arguments viables des deffenseurs des princeps sont
les médicaments à faible marge thérapeutique ( et encore ! si la qualité est au rdv je ne vois pas ce qui pose probleme surtout si une fois le génerique instauré on éffectue un ajustement posologique (contraingnant))
et les médicaments antiépileptiques, neuroleptiques … qui surtout ceux qui touchent à la psyché.
pour ce qui est des hormones thyroidiennes et du préviscan je ne vois pas ou est le souci car une fois la posologie adaptée a la nouvelle TSH ou INR tout est stable sachant que de toute facon même sans parlé de génériques les variations en fonction d’une prise à jeun d’une alimentation irrégulière, d’infection intestinal bref de beaucoup de facteurs sont énormes! SEUL PROBLEME il faut alors toujours le meme générique et pas en changer tout les 4 mois.
Oui, il ne faut pas changer de marque de générique, tout le paradoxe est là ! car ce sont les pharmaciens qui changent le laboratoire du générique. La situation devient … comment dire … épique, ubuesque, absurde ( j’hésite ) car je prescris maintenant une molécule en générique avec le laboratoire et je marque « non substituable » pour que le pharmacien ne change pas le labo de fabrication ( typique avec certaines allergies d’excipient ) ça promet tout ça, ça promet !!
Les génériqueurs sont principalement l’Inde et la Chine car ce sont eux aussi qui ont l’industrie chimique qui fabrique les matières premières.
Certains princeps sont fabriqués en diverses étapes et divers lieux, la partie la plus sophistiquée se faisant sous nos cieux, mais pas toujours.
Les usines chinoises et indiennes sont régulièrement visitées par la FDA et l »EMA, même si, parfois, il y a quelques gags !
Un sel bioéquivalent différent du princeps d’origine peut devenir princeps à la place du princeps. Nous avons l’exemple du PERINDOPRIL anciennement « tert-butylamine » et actuellement « arginine ». Le nouveau COVERSYL n’est-il pas un générique de l’ancien tout simplement?
Quelques passages de la fiche de transparence concernant le PRETERIAN ci-dessous (le nom ayant servi à la demande d’AMM pour le nouveau PRETERAX avant la disparition de l’ancien). Ce fut un nom transitoire en attendant le switch de « l’ancien » par « le nouveau ». Même ruse que celle employée pour le BIOCOVERSYL (l’ancien nouveau nom du nouveau COVERSYL…).
Extraits de la fiche de transparence du PRETERIAN:
« Analyse des données disponibles :
Le dossier repose sur une étude de bioéquivalence (CLI-06590-001-FRA) entre le sel de périndopril tert-butylamine 4 mg + indapamide 1,25 mg (BI-PRETERAX) et le sel de périndopril arginine 5 mg + indapamide 1,25 mg (PRETERIAN) réalisées chez 34 volontaires sains.
Cette étude a démontré la bioéquivalence des deux sels sur les paramètres cinétiques étudiés (Cmax, Tmax, aire sous la courbe).
Amélioration du service médical rendu :
PRETERIAN 2,5 mg / 0,625 mg et 5 mg / 1,25 mg n’apportent pas d’amélioration du service médical rendu (ASMR V), respectivement par rapport à PRETERAX et BI-PRETERAX.
De plus, les spécialités PRETERIAN 2,5 mg / 0,625 mg et 5 mg / 1,25 mg associations fixes de périndopril arginine (2,5 ou 5 mg) et d’indapamide (0,625 ou 1,25 mg) mg n’apportent pas
d’amélioration du service médical rendu (ASMR V) par rapport à l’utilisation conjointe de chacun de leurs composants pris séparément.
La Commission note que l’intérêt d’une association à dose fixe dans la prise en charge des patients hypertendus par rapport à la prise séparée des (deux) médicaments n’est pas établi. »
Vous ne trouverez pas les fiches de transparence concernant 1°) le PRETERIAN et 2°) son changement de nom sur le site de la HAS. Il faut les demander pour les obtenir.
Nos merveilleux experts pourtant ne rechignent pas à s’exprimer dans des articles de la presse médicale gratuite à côté de jolies publicités pour le nouveau COVERSYL, le nouveau PRETERAX, l’extraordinaire innovation COVERAM.
Cherchez l’erreur!
Merci pour ta note très didactique.
Aider les patients, c’est probablement les aider à devenir plus autonome dans la gestion de leur traitement et c’est arrêter de les inquiéter avec les médicaments génériques. L’éducation thérapeutique (plus que les pilules combinées)peut probablement aider à une meilleure observance.
Prescrire en DCI en indiquant le nom de marque entre parenthèses quand c’est nécessaire (pour les médicaments non disponibles en version générique en pharmacie) est peut être la moins mauvaise solution. Ça limite le hiatus entre le libellé de l’ordonnance et la façade des boîtes. Ça permet la continuité du discours thérapeutique entre l’ordonnance du médecin et la dispensation en officine. Ça peut aider le pharmacien à recentrer son activité sur la thérapeutique et sur l’aspect très concret de la prise médicamenteuse en vérifiant comment le patient réagit à la confrontation « ordonnance » et « boîtes ».
Apprendre au patient, non pas forcément à mémoriser les DCI, mais simplement à vérifier la conformité de ce qu’il prend avec l’ordonnance est probablement une démarche plus pragmatique et sécurisante qui peut éviter deux types d’erreur:
1°) Se fier à l’aspect du médicament. L’exemple très cardiologique du LISINOPRIL EG 20 MG et du PREVISCAN est assez démonstratif:
http://www.afssaps.fr/Infos-de-securite/Communiques-Points-presse/Risque-de-confusion-entre-comprimes-de-Previscan-20-mg-et-de-Lisinopril-EG-20-mg-Communique
L’Afssaps rappelle à cette occasion les bonnes pratiques de l’administration:
« L’Afssaps recommande aux patients traités avec ces deux médicaments, de les conserver dans leur plaquette de présentation de manière à pouvoir les identifier au moment de la prise et éviter ainsi toute confusion. » Cette recommandation vaut pour tous les médicaments… à mon avis et non pas seulement dans ce cas! Face à la diversité des médicaments génériques, il faut lire l’étiquetage.
2°) Répéter une erreur « génétiquement » programmée dans le nom de fantaisie du médicament par exemple entre LAMISIL 250 mg et LAMICTAL 200 mg :
http://www.afssaps.fr/Infos-de-securite/Lettres-aux-professionnels-de-sante/Information-de-pharmacovigilance-Erreurs-de-delivrance-confusion-entre-LAMICTAL-R-lamotrigine-et-LAMISIL-R-terbinafine-a-l-origine-de-reactions-cutanees-graves-ou-de-crises-convulsives-Lettre-aux-professionnels-de-sante
Dans ce cas, ces deux médicaments étant disponibles en version générique, une prescription en DCI écarte tout risque de confusion (TERBINAFINE et LAMOTRIGINE).
Apprendre au patient à devenir plus autonome dans la prise de ses médicaments et prendre sa part de responsabilité dans le circuit du médicament, c’est prendre en compte la réalité de ce que vit le patient au-delà de la rédaction de l’ordonnance.
Probablement nous faut-il penser à sortir de notre position « confortable » de déni et du « non substituable » comme réponse « magique » à une réalité difficile à gérer parce que nous n’avons pas voulu la regarder en face ni l’accepter.
Trés intéressant. Et puis ça me rassure qu’il y ait des documents « techniques » que vous ne compreniez pas…
Je me suis posée une question lors de la lecture de votre article: est ce que les co marketing comme LERCAN et ZANIDIP ont les mêmes obligations de bio equivalence, et quel est le pourcentage de différence entre 2 co marketings en moyenne, et lequel prend on alors comme repère par rapport aux génériques?… Finalement j’en suis à 3 questions… je vais fouiller un peu sur google… A chercher des réponses on finit par se poser finalement plus de questions….