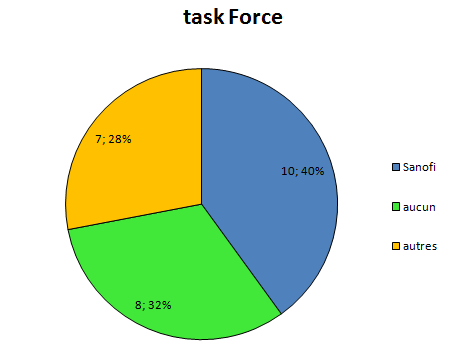
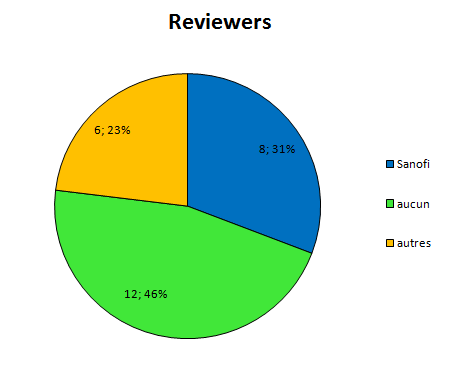
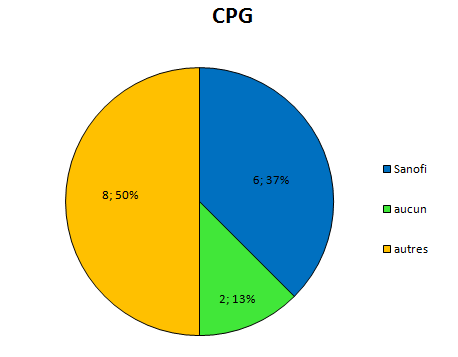
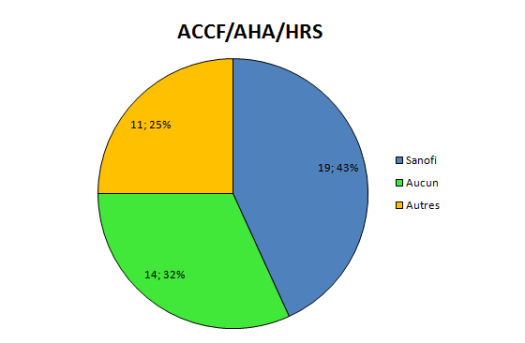
Depuis pas mal de temps, j’essaye de visualiser l’interdépendance entre les médecins prescripteurs et l’industrie pharmaceutique.
Étant donnée l’actualité, j’ai un peu plus réfléchi au problème et j’en ai tiré ce schéma:
Bon, c’est un mauvais schéma car ça part dans tout les sens, et il n’est ni esthétique, ni explicatif.
Mais j’ai essayé d’être complet.
Quand on y pense, l’industrie porte à bout de bras, à bout de portefeuille, je devrais dire, une grande partie de l’environnement du médecin.
Elle finance très partiellement ou en totalité:
-
les essais cliniques
-
les journaux scientifiques (achat d’encarts publicitaires et de tirés à part)
-
les journaux pseudo scientifiques (achat d’encarts publicitaires et achat d’abonnements)
-
la FMC (financement des Enseignements Post Universitaires)
-
certaines écuries qui aident les étudiants au cours de leur scolarité, certaines bourses, les supports pédagogiques individuels, mais aussi collectifs au sein des services (projecteurs…).
-
les sociétés savantes (partenariat institutionnel, aide au financement des journées…)
-
certaines associations de patients
Elle a des liens financiers avec un certain nombre d’experts qui sont présents, par leur expertise même au sein de 4 structures différentes qui vont influencer directement ou non la prescription médicale:
-
la Faculté
-
les sociétés savantes
-
les agences de régulation sanitaire
-
et bien sûr l’industrie elle-même par le biais des départements recherche et développement, et leurs services commerciaux.
Ne me faites pas dire ce que je n’ai pas dit, je ne dénigre pas l’expertise ni les experts. On ne fait pas partie des « méchants » si on bosse avec l’industrie. C’est un choix personnel qui n’est pas déshonorable.
Mais la présence d’experts ayant des liens financiers avec l’industrie au sein des facultés, des agences de régulation et des sociétés savantes doit faire se poser au minimum le problème des conflits d’intérêt.
Hormis en passant des diplômes complémentaires à la Faculté (et ils remplissent mal ce rôle de mise à jour), il est quasi-impossible à l’heure actuelle pour un médecin de suivre un enseignement post-universitaire indépendant, sans parler même de se tenir au courant.
Ce schéma montre à quel point la réforme de nos relations avec l’industrie est nécessaire, mais aussi et surtout à quel point elle sera complexe à mettre en œuvre.
Il n’existe aucune solution simple, encore moins simpliste.