J’adore ce genre de titre très pompeux qui couronne une note écrite à l’arraché sur un coin de table un samedi matin, c’est à dire sans beaucoup d’analyse.
Alors, soyez déçus!
L’Exanta (Ximélagatran) est un inhibiteur direct de la thrombine qui devait enfin remplacer les AVK au début des années 2000. C’était donc un immense espoir pour tout le monde, et bien entendu pour la firme qui le commercialisait, Astra-Zeneca.
Son AMM a été octroyée en France le 23/12/2003.
Patatras, le 14/02/2006, la firme demande de son propre chef son retrait du marché mondial devant la découverte d’un cas d’hépatite grave dans un essai clinique post-AMM demandé pour une extension de cette dernière (EPAR de février 2006)
Vous allez me dire qu’il est étonnant de retirer un médicament devant un seul cas d’hépatite, même grave. Mais je crois que le ximélagatran avait déjà provoqué quelques inquiétudes dans des essais précédents puisque son RCP de l’époque précisait:
Insuffisance hépatique et anomalies des transaminases EXANTA 24 mg, comprimé pelliculé est contre-indiqué en cas d’insuffisance hépatique et/ou si le taux d’ALAT est supérieur à 2 fois la limite supérieure de la normale avant traitement. Un dosage des ALAT doit être effectué avant l’intervention chirurgicale.
Dans le cas de la dronédarone (Multaq®), la FDA a publié hier cette alerte faisant état de plusieurs incidents hépatiques, dont 2 ont conduit à des transplantations chez des patients sous dronédarone depuis 4.5 et 6 mois.
Bon, pour l’instant, il y a un doute, et je présume que tous les cas sont en cours d’analyse pour affirmer ou non l’imputabilité de la dronédarone.
Bien entendu, tout le monde se demande si ces cas vont conduire à un retrait de la dronédarone, ce qui ne serait pas une grosse perte d’un point de vue thérapeutique, mais qui serait un nouveau coup de canif dans l’évaluation des risques par les agences de régulation sanitaire.
Le RCP de la dronédarone ne mentionne aucun effet secondaire hépatique, et si elle est contre-indiquée chez les patients insuffisants hépatiques, elle l’est par manque de données:
Hepatic impairment MULTAQ is contraindicated in patients with severe hepatic impairment because of the absence of data (see section 4.3). No dose adjustment is required in patients with mild or moderate hepatic impairment (see section 5.2).
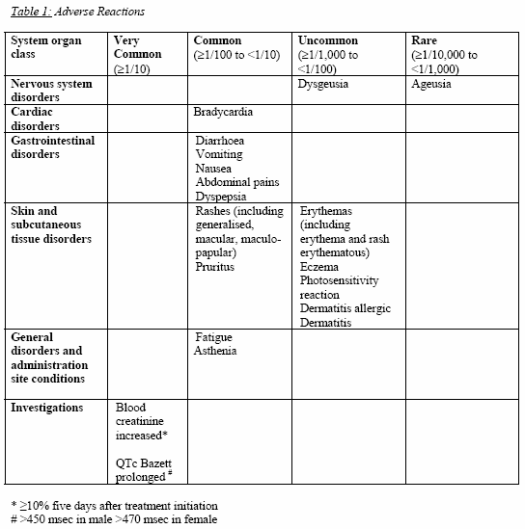 Donc aucun signal qui pointe vers le foie, même en cours d’investigation.
Donc aucun signal qui pointe vers le foie, même en cours d’investigation.
Par contre, si on regarde la fiche de transparence de la HAS, on découvre ce petit paragraphe:
Les événements indésirables les plus fréquemment observés au cours de ces études ont été les suivants : troubles gastro-intestinaux (diarrhée, nausées) troubles électrocardiographiques (bradycardie, allongement du QT), oedème périphérique, dyspnée, toux, vertiges, élévations des transaminases, élévation du taux de créatinine sérique.
Elévation des transaminases! Pourquoi cela n’apparait nulle part ailleurs?
Je présume que c’est parce que les experts de la HAS ont regardé les pourcentages d’effets secondaires uniquement dans le groupe dronédarone, sans les comparer avec le groupe placebo/amiodarone, donc sans les pondérer (ce n’est en aucun cas une critique!).
En effet, lorsque l’on consulte les données de sécurité de la FDA (page 119), on retrouve des anomalies hépatiques, mais pas significativement plus fréquentes que dans le groupe placebo:
Laboratory evaluation: Liver enzymes were measured in 4 studies in AF/AFL patients: DAFNE, EURIDIS, ADONIS, and ERATO (enzymes not collected in ATHENA). Overall, the percentages of patients with abnormalities in laboratory hepatic tests (ALT or AST >2 ULN, >3 ULN, or >5 ULN; or ALP >1.5 ULN; or total bilirubin ≥ 34 μmol/L) were similar in the dronedarone 400 mg BID and placebo groups. At the proposed therapeutic dose of dronedarone (400 mg BID), the mean changes from baseline in ALT and AST were similar to those observed in the placebo group.
…
Adverse events: The overall incidences of TEAEs, serious TEAEs and TEAEs leading to permanent study drug discontinuation reported in the MedDRA SOC “hepatobiliary disorders” and in the HLT “liver function analyses” were similar in the dronedarone 400 mg BID (1.6%) and the placebo (1.5%) groups. Among the hepatobiliary disorders in the “hepatocellular damage and hepatitis” HLT, two cases were reported as SAEs with an outcome of death, one case of hepatitis toxic (preferred term) in the dronedarone 400 mg BID group with ALT >3ULN and Total Bilirubin >2ULN suggestive of autoimmune acute hepatitis, and one case of cytolytic hepatitis in a context of severe cardiac disease was reported in the placebo group. Pooled data from five AF/AFL studies showed similar incidence of specific hepatic events included in the SOC ‘Hepatobiliary disorders’ and the standard MedDRA query (SMQ) “Liver related investigation signs and symptoms” in the dronedarone 400 mg BID (2.9%) and the placebo (2.5%) groups.
…ou dans le groupe amiodarone dans DIONYSOS:
The incidence of serious TEAEs of the “Hepatobiliary disorders” SOC was 0.8% (2 patients) in both treatment groups. Two cases presented with ALT>3 ULN and Total Bilirubin >2ULN were reported in the dronedarone group: one case of acute hepatocellular injury suspected to be due to hepatic ischemia secondary to transient low cardiac output and one case of mixed liver injury occurring in the context of pancreatic cancer leading to death. In the amiodarone group, one case of cholangitis and one case of acute cholecystitis were reported as serious TEAEs.
Donc rien de bien palpitant…
Si l’on regarde maintenant encore un peu plus en amont, c’est à dire chez l’animal, on ne retrouve pas non plus de problème hépatique particulier (à dose thérapeutique):
Liver changes: Hepatic effects (isolated increases in transaminases and/or alterations in bilirubin as well as histopathological changes essentially in the biliary tract) were seen at high doses in short term studies in the rat and the dog. These were considered to be secondary to high dose toxicity as they did not occur in isolation but as part of a spectrum of signs of general toxicity and health deterioration. In addition in the rat these signs were observed at doses causing death or exceeding the maximal tolerated dose (MTD). The biochemical changes did not correlate with the histopathological findings which were considered to be linked more to the physicochemical properties of the compound. At lower doses and longer term treatment no consistent hepatic changes were observed and when present showed a lack of dose response and time dependency, with in addition, the presence of similar changes in control animals on certain studies.
Que c’est-il passé depuis que la dronédarone a eu son AMM, notamment aux Etats-Unis?
Ben, d’un point de vue hépatique, jusqu’à l’alerte de la FDA, rien à ma connaissance.
Par exemple, le relevé des effets secondaires publié par les chiens de garde de The Institute for Safe Medication Practice en novembre 2010, on ne trouve pas de problème hépatique.
Alors?
Si les insuffisances hépato-cellulaires rapportées sont en effet liées à la dronédarone, serons-nous confrontés à une nouvelle faillite de l’évalutation pré-AMM?
Je ne le crois pas, car toute évaluation d’un médicament avant sa commercialisation se heurte à un vice de forme parfaitement infranchissable, celui des statistiques.
Page 137 du rapport de la FDA, débute le très fastidieux tableau de l’évaluation de sécurité. Les comparaisons s’effectuent principalement entre deux groupes, dronédarone et placebo.
Regardons les effectifs: 3383 patients par an dans le groupe placebo, 3684 dans le groupe dronédarone 400mg*2.
Ces populations sont relativement importantes car le programme mis en place par Sanofi est assez conséquent. Mais elles sont parfaitement ridicules par rapport au nombre de gens qui ont pris de la dronédarone depuis sa sortie aux Etats-Unis il n’y a que six mois:
Dronedarone is a drug used to treat abnormal heart rhythm in patients who have had an abnormal heart rhythm (atrial fibrillation or atrial flutter) during the past 6 months. Dronedarone can reduce the risk of being hospitalized for these heart problems. Since dronedarone’s approval in July 2009 through October 2010, around 492,000 dronedarone prescriptions were dispensed and around 147,000 patients filled dronedarone prescriptions at outpatient retail pharmacies in the United States.
492000 lignes de prescription pour 147000 patients!
Il est donc évident qu’avec une telle population, on va mettre en évidence des problèmes de sécurité qui vont être parfaitement indétectables en pré AMM (si les études animales, les études PK/PD… n’ont rien montré).
Dans le cas du ximélagatran, des petits indices pré-cliniques et surtout la « chance » d’avoir mis en évidence une hépatite au cours d’un essai ont ainsi permis d’éviter une trop longue commercialisation.
Il est aussi parfaitement évident qu’avec une telle loupe (mais qui est en fait la « vie réelle »), les problèmes de sécurité vont rapidement prendre une ampleur importante, « médiatique », si j’ose dire.
Rien de dépisté en plusieurs années d’études pré-AMM mais déjà potentiellement deux transplantations hépatiques en 6 mois de commercialisation!
D’où l’intérêt fondamental de la pharmacovigilance en post AMM, et mon attitude de praticien qui ne prescris un nouveau traitement que primo si il est efficace, (quand même!) et secundo, si il a déjà plusieurs mois de mise sur le marché derrière lui. Évidemment, ce dernier point ne me semble pas de mise en cas d’absence d’alternative thérapeutique pour une pathologie grave, mais ce cas reste rare (du moins en cardio ces dernières années).
Enfin dernière remarque qui m’énerve beaucoup.
L’alerte de la FDA date d’hier, et je présume qu’elle ne concerne pas que les patients américains sous dronédarone. A cette heure, toujours rien sur les sites de l’Afssaps et de l’EMA.
Euuhh, les gars, il faudrait peut-être un peu vous réveiller et au minimum répercuter cette alerte vers les prescripteurs, même si à l’heure actuelle, il ne s’agit que d’un doute. On est à l’heure d’internet, pas du télégraphe Chappe et tous les praticiens européens et a fortiori français ne suivent pas le compte Twitter de la FDA, sans même parler de lire l’anglais:
https://twitter.com/#!/FDA_Drug_Info/status/25921518953304064
…
Back to The Trees!







